来源:未知 时间:2025/02/18 作者:admin2021
这篇Analytical Chemistry文章发表于2024年12月;文章的第一作者为Junyang Chen,通讯作者为Wei Li,工作单位为郑州大学基础医学院。该研究通过针对FAP蛋白糖基化的适配体筛选策略,成功开发出一种基于双适配体的表面增强拉曼散射(SERS)免疫夹心测定法,实现了对FAP的高灵敏度和高选择性检测,为癌症诊断提供了一种新的、高效且具有临床应用潜力的检测方法。

这篇论文开发了一种基于双适配体的表面增强拉曼散射(SERS)免疫夹心测定法(odA-PISA),用于高灵敏度和高选择性检测FAP。该方法结合了糖基化靶向适配体(Seq2T)和蛋白结合适配体(A1),利用SERS技术实现了对FAP的快速、准确检测。
糖基化靶向适配体(Seq2T):通过SELEX技术筛选出针对FAP糖基化的高性能适配体Seq2T,其表观解离常数(KD)为9.74 nM,具有高亲和力和特异性。
蛋白结合适配体(A1):选择已报道的FAP蛋白结合适配体A1,其KD值约为500 nM,用于标记FAP蛋白。
适配体修饰:Seq2T通过硫醇基团(-SH)固定在金涂层基底上,A1适配体修饰在银基拉曼活性纳米标签上。
目标捕获:将待测样本(如血清样本或标准FAP溶液)添加到修饰有Seq2T的金涂层基底上,FAP蛋白与Seq2T特异性结合。
标记:将A1适配体修饰的银基拉曼纳米标签添加到捕获的FAP蛋白上,形成夹心复合物。
信号读出:通过SERS技术检测拉曼信号,拉曼信号的强度与FAP蛋白的浓度成正比。
基底制备:将金涂层玻璃片(25×10 mm)制备成三点阵列,用于固定Seq2T适配体。
目标捕获:将5 μL的FAP标准溶液或血清样本添加到每个阵列点上,孵育20分钟,然后用10mMPBS缓冲液洗涤三次,去除未结合的物质。
标记:将5μL的A1适配体修饰的拉曼纳米标签添加到阵列上,孵育5分钟,然后用10mMPBS缓冲液洗涤三次,去除多余的纳米标签。
信号读出:将阵列干燥后,通过拉曼光谱仪读取信号,记录1435cm⁻¹处的拉曼强度。

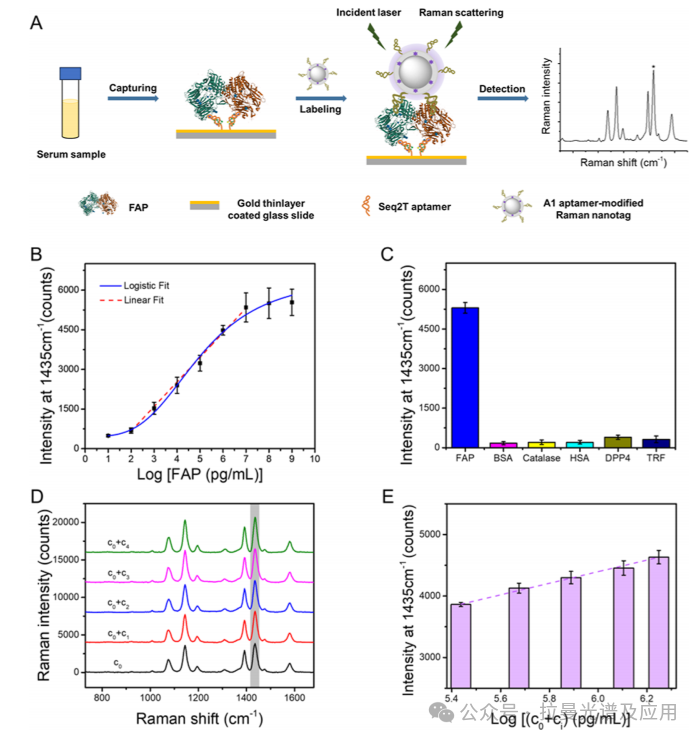 图4(A):展示了odA-PISA检测FAP的原理示意图。图中详细描述了Seq2T适配体固定在金涂层基底上,捕获FAP蛋白,然后用A1适配体修饰的银基拉曼纳米标签进行标记,最终通过SERS技术读取信号。该图清晰地展示了odA-PISA的检测流程,包括适配体的固定、目标蛋白的捕获、标记和信号读出。通过这种夹心结构,实现了对FAP的高灵敏度和高选择性检测。
图4(A):展示了odA-PISA检测FAP的原理示意图。图中详细描述了Seq2T适配体固定在金涂层基底上,捕获FAP蛋白,然后用A1适配体修饰的银基拉曼纳米标签进行标记,最终通过SERS技术读取信号。该图清晰地展示了odA-PISA的检测流程,包括适配体的固定、目标蛋白的捕获、标记和信号读出。通过这种夹心结构,实现了对FAP的高灵敏度和高选择性检测。
图4(B):展示了odA-PISA的Raman强度与FAP浓度对数之间的线性关系。图中绘制了不同浓度FAP标准溶液的Raman强度,拟合得到的线性方程为y=−1197.20+930.67x,R² =0.997,该图表明odA-PISA在100 pg/mL至10 μg/mL的浓度范围内具有良好的线性响应,检测限为100 pg/mL。这表明该方法具有高灵敏度,能够检测到极低浓度的FAP。
图4(C):展示了odA-PISA对不同蛋白质的选择性测试。图中比较了FAP与其他五种干扰蛋白(包括人血清白蛋白)的Raman信号强度。结果显示,FAP的Raman信号远高于其他干扰蛋白,交叉反应性仅为3.3%至7.4%。这表明odA-PISA具有极高的选择性,能够特异性检测FAP。
通过开发odA-PISA,研究者不仅实现了一种高灵敏度和高选择性的FAP检测方法,还展示了其在实际临床样本中的应用潜力。



